Parkinsonismo Asociado con Lyme
Un Estudio de Caso Neuropatológico y Revisión Bibliográfica
David S. Cassarino, MD, PhD; Martha M. Quezado, MD; Nitya R. Ghatak, MD;
Paul H. Duray, MD
|
aFrom the Laboratory of Pathology, National Cancer Institute, National Institutes of Health, Bethesda, Md (Drs Cassarino, Quezado, and Duray); and the Departments of Pathology and Neuropathology, Virginia Commonwealth University, Richmond (Dr Ghatak) |
Accepted April 11, 2003
●Las complicaciones neurológicas de la Enfermedad de Lyme incluyen meningitis, encefalitis, demencia, y, raramente, parkinsonismo. Presentamos un caso de degeneración estriatonigral, una forma de atrofia multisistémica, en parkinsonismo asociado con Lyme. Un hombre de 63 años de edad se presentó con el sarpullido de erythema migrans, dolores de articulaciones, y temblores. El suero, anticuerpo del líquido cerebroespinal y la reacción en cadena de la polimerasa para la Borrelia burgdorferi fueron positivo. Parkinsonismo clínico fue diagnosticado por varios neurólogos. A pesar del tratamiento, el paciente continuó desmejorando, con incapacidad progresiva, disfunción cognoscitiva, rigidez, y falla pulmonar. En la autopsia, el cerebro mostró leve atrofia de los ganglios basales y despigmentación de substancia nigra, con extenso veteado y pérdida de la substancia nigra neuronal y astrogliosis. Ningún cuerpo de Lewy fueron identificados; sin embargo, inclusiones citoplasmáticas gliales de ubiquitina-positiva fueron identificadas en el veteado y la oligodendroglia nigral. No habían infiltrados peri-vascular ni meníngeos, los clásicos resultados de neuroborreliosis. Según nuestro conocimiento, este es el primer reporte de degeneración estriatonigral en un paciente con la infección de B. burgdorferi del sistema nervioso central y parkinsonismo clínico asociado con Lyme.
La enfermedad de Lyme es una infección causada por Borrelia burgdorferi, una espiroqueta transmitida por garrapatas Ixodes en los Estados Unidos. Los pacientes a menudo se presentan, inicialmente, con el clásico sarpullido de erythema migrans, un área circular, macular, eritematoso, con aclaración central que se ensancha alrededor del sitio de la picadura de garrapata. El sarpullido empieza generalmente dentro de 3 a 30 días después de la picadura, pero sólo se encuentra en alrededor de 60% de pacientes.1 Pacientes con larga trayectoria de Enfermedad de Lyme pueden desarrollar miocarditis, oligoartritis de las articulaciones grandes, y la participación del sistema nervioso central (típicamente meningitis, encefalitis, y neuropatía craneal, y, raramente, ganglios basales y disfunción cognoscitiva) en la fase terciaria de la enfermedad. También han habido casos reportados de pacientes con la Enfermedad de Lyme desarrollando parkinsonismo clínico. 2–6 Nosotros describimos lo que a nuestro conocimiento es el primer caso con seguimiento de autopsia.
Pacientes con meningitis de Lyme a menudo muestran números aumentados de linfocitos y células de plasma en el pia y membrana arácnida, con algunos linfocitos atípicos.1 En la encefalitis de Lyme, hay edema, activación microglial, e infiltrados linfoplasmacíticos intra-parenquimal en una distribución predominantemente perivascular.1 Estos resultados estaban ausentes en el caso actual. En cambio, el cerebro mostró pérdida neuronal, gliosis, e inclusiones citoplásmicas gliales en el estriatum y la substancia nigra, llevando al diagnóstico de degeneración estriatonigral (SND).
Degeneración estriatonigral ahora es reconocida de ser un subtipo de atrofia multisistémica (MSA), una enfermedad neurodegenerativa relativamente poco común, caracterizada por la pérdida neuronal y astrocitosis de los ganglios basales y substancia nigra, con características de inclusiones citoplasmáticas gliales de ubiquitina-positiva. 7 Estas inclusiones contienen a-sinucleina, que se pueden identificar inmunohistoquímicamente en células gliales. Según nuestro conocimiento, la presencia de inclusiones citoplasmáticas gliales y a-sinucleina, no han sido previamente reportados en cerebros de pacientes con la enfermedad de Lyme.
INFORME DE UN CASO
El paciente era un hombre blanco, de 63 años de edad, previamente sano que en junio de 1995 se presentó con un sarpullido de erythema migrans en el interior de su muslo izquierdo. Durante el año subsiguiente, el desarrolló un dolor musculoesquelético difuso, hinchazón de la rodilla izquierda, temblor de la mano izquierda, y dolor en el hombro y brazo izquierdo. En junio de 1996, el diagnóstico de Enfermedad de Lyme se hizo basado en una prueba de Western blot que mostraba B. burgdorferi- específicas bandas de inmunoglobulina (Ig) G. Los dolores musculoesqueléticos del paciente y el temblor de la mano empeoraron durante los próximos meses, con pérdida de función. En agosto de1996, el fue tratado por 3 semanas con (IV) ceftriaxone intravenoso sin ninguna mejoría. En febrero de 1997, un escán de imágenes por resonancia magnética de la cabeza y el cuello fue supuestamente normal. El reasumió la terapia antibiótica con 2 semanas de IV ceftriaxone y luego 42 días de sodio IV cefotaxime, con una pequeña mejoría en su condición. En mayo de 1997, se obtuvo una consulta neurológica, y en ese momento a través de una punción lumbar el líquido cerebroespinal se encontró ser positivo a B. burgdorferi-especifica IgG por el enzimoinmunoanálisis absorbente (ELISA). El examen neurológico documentó parkinsonismo, que fue atribuido a neuroborreliosis de Lyme. El tratamiento farmacológico se inició, sin beneficio aparente.
En julio de 1998, el paciente había perdido 20 kg y había desarrollado síntomas, incluyendo: fatiga crónica, temblores, y dolores en el cuello y en ambas manos; sus movimientos eran tiesos y dolorosos. En agosto de 1998, el desarrolló también rigidez en el tejido muscular, que esta marcado por movimiemtos bruscos, cuando el musculo deberia estirarse. Debido al continuo empeoramiento clínico, él fue iniciado en un tratamiento de antibióticos orales, incluyendo clarithromycin, ciprofloxacin, y hydroxychloroquine. Sus temblores parecieron mejorar después del tratamiento; sin embargo, sus otros síntomas continuaron constantemente. En noviembre de 1999, la prueba de Western blot para B. burgdorferi– anticuerpos específicos IgM (30, 34, 41, y 93 kd) y IgG (30, 39, 41, 58, 66, y 93 kd) fueron positivo. A pesar de continuados tratamientos de antibióticos, los movimientos anormales del paciente continuaron progresando. Por mayo de 2000, él presentó memoria disminuida, incontinencia, baboseo, y la incapacidad de ambular independientemente o de cuidarse el mismo. El líquido cerebroespinal y pruebas de sangre de reacción de la polimerasa en cadena (PCR) en aquel momento para la especie de Borrelia eran positivos, y el PCR para la especie de Babesia era negativo. Un cultivo de glóbulos rojos mostró espiroquetas clásicas en sus células rojas. Se continuó con una terapia antibiótica multiagente oral.
En diciembre del 2000, el paciente fue admitido en el hospital por una pulmonía de aspiración y fue tratado con antibióticos y nutrición parenteral. El fue readmitido en enero del 2001 por otro episodio de pulmonía de aspiración. El obtuvo un cultivo de esputo que fue positivo para el Estafilococo aureus, y fue tratado con IV vancomicina. En febrero del 2001, un cultivo de esputo fue supuestamente positivo para B. burgdorferi. Una repetida prueba de Western blot para Borrelia IgM y IgG fue positiva, y PCR para organismos de Babesia fue también positivo. A pesar de los tratamientos de antibióticos continuados (IV vancomicina, azithromycin, y atovaquone), la condición neurológica del paciente continuó disminuyendo, y finalmente sucumbió a la infección y fracaso respiratorio en abril de 2001. Una autopsia completa fue realizada.
RESULTADOS PATOLOGICOS
El examen microscópico reveló pocos resultados significativos. Externamente, había múltiples moretones, marcas de IV, y úlceras decubitales sobre el sacro. Las cavidades del pecho contenían líquido y había efusiones pleurales bilaterales. El cerebro y la médula espinal eran externamente comunes; en seccionamiento, los ganglios basales mostraron leve atrofia bilateral (Figura 1), con grandes cambios en la izquierda, y la substancia nigra mostró despigmentación. El cerebelo también parecía mostrar una leve atrofia.
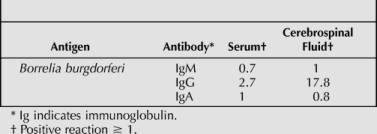
El examen microscópico del corazón mostró células dispersas de linfocitos y plasma, con áreas de leve fibrosis, sugiriendo una posible miocarditis. No se identifico ninguna inflamación significativa en ningún otro órgano. El cerebro mostró extensa pérdida neuronal y astrogliosis severa en el estriatum (Figura 2) y substancia nigra (Figura 3). Otras regiones del cerebro no fueron afectadas. No se identificó ningún cuerpo de Lewy; sin embargo, inclusiones citoplasmáticas gliales de ubiquitina-positivas fueron identificadas en el oligodendroglia, dispersada en el estriatum (Figura 4) y substancia nigra, pero no en el puente de Varolio (incluyendo el núcleo olivario) ni el cerebelo. Estas inclusiones citoplasmáticas gliales también se mancharon positivamente con a-sinucleina inmunohistoquímicamente (Figura 5). Estudios de premortem, prueba Western blot y ELISA mostraron reacciones positivas para Borrelia- específicos anticuerpos IgM y IgG en ambos, suero y muestras del líquido cerebroespinal (CSF) (Tablas 1 y 2). Se realizó el análisis de reacción en cadena de la polimerasa para Borrelia-secuencias específicas en la substancia nigra y ganglios basales; sin embargo, los resultados no pudieron ser confirmados en el tejido postmórtem.
COMENTARIO
Hasta donde conocemos, este reportaje describe el primer caso del origen de parkinsonismo en asociación con la Enfermedad de Lyme que llegó a autopsia. El estudio histológico del cerebro demostró cambios morfológicos típicos de SND, una variante de MSA. El diagnóstico del paciente con Enfermedad de Lyme fue bien documentado, confirmado por ambos suero y CSF ELISA, Western blots, y estudios de PCR premortem. El paciente desarrolló los signos y los síntomas de MSA después de su presentación con el sarpullido de erythema migrans, y no había historia previa de disfunción neurológica. Aunque no se puede excluir que el SND se pudo haber desarrollado independiente de su Enfermedad de Lyme, la asociación temporal con terciaria Enfermedad de Lyme, la alta cantidad de anticuerpos de Borrelia en su CSF, y el PCR premortem para B. burgdorferi- específicas secuencias en el CSF favorecen una asociación. El hecho de que los clásicos cambios inflamatorios asociados con la Enfermedad de Lyme estaban ausentes puede indicar una atípica infección del sistema nervioso central en este paciente, o meramente que la infección y la inflamación se había resuelto al tiempo de su muerte (que ocurrió 5 años después de la infección y después de múltiples cursos de antibióticos). En la mayoría de los casos, los organismos no se pueden identificar en secciones histológicas. 1,6
A pesar de si la infección se había resuelto al tiempo de su muerte, nosotros hipotetizamos que era suficiente para causar la pérdida neuronal progresiva y astrogliosis que inducen a SND. Por lo tanto, los estudios negativos para organismos en el tejido postmórtem pueden reflejar, o la ausencia de organismos o la persistencia de números bajos de espiroquetas y resultados falsos-negativos. En general, nosotros creemos que el SND y parkinsonismo resultante en este caso quizás se relacione a la infección directa por organismos de Borrelia, o a la respuesta inmune contra los organismos, y estos resultados son por lo tanto de interés particular porque la etiología de SND y MSA es desconocida.
El diagnóstico clínico de MSA está basado en criterios de diagnósticos, incluyendo parkinsonismo con respuesta pobre o parcial a la terapia de L-dopa. Los pacientes a menudo desarrollan disfunción bulbar progresiva que lleva a disfagia y estridor laríngeo, predisponiendo eventualmente a la pulmonía por aspiración. 7 El parkinsonismo de nuestro paciente era resistente a medicinas tradicionales, y él desarrolló los signos clásicos de parkinsonismo así como disfagia, consistente con el curso clínico de MSA. En un previo informe extrapiramidal de Lyme-asociado característico en 5 pacientes, 5 todos los pacientes exhibieron aquinesia, dolores, y rigidez, semejante a nuestro paciente, aunque sólo 2 desarrollaron temblores. Cuatro de los 5 pacientes también desarrollaron disfunción bulbar, un hallazgo característico en MSA. Aunque a ninguno de estos pacientes se le realizó una autopsia, y por lo tanto no pueden ser diagnosticados definitivamente con MSA, los hallazgos clínicos eran consistentes con esta conclusión y eran generalmente semejantes a hallazgos en nuestro caso. Una diferencia significativa era que estos pacientes respondieron a medicinas de anti–Parkinson, que es inusual en MSA, y ellos también mejoraron con antibióticos. Esta diferencia puede indicar una patología fundamental diferente comparada con el presente caso, en el cual había poca o ninguna mejora con drogas de anti-Parkinson y antibióticos. Alternativamente, como nuestro paciente no recibió antibióticos hasta 14 meses después de la infección inicial, él pudo haber sufrido el daño irrevocable neuronal antes de que el tratamiento fuera iniciado.
Los estudios de cerebro de autopsias en pacientes con la Enfermedad de Lyme son limitados a casos clínicos aislados o a una serie de pocos casos. Además de meningoencefalitis, otros múltiples descubrimientos neuropatologicos han sido reportados. En la autopsia, se encontró que un paciente tenía romboencefalitis, con microgliosis y vasculopatía inflamatoria obliterante asociado con infartos isquémicos.2 Otro caso mostró inflamación multifocal, pérdida de célula neuronal, desmielinización, y astrocitosis en la corteza, tálamo, cerebelo, y en la médula espinal.3 Bertrand et al4 reportó 3 casos, 1 de los cuales mostró participación cortical, y los 3 mostraron cambios en la sustancia blanca cerebral y cerebelar, con infiltrados linfocitarios, activación microglial, cambios espongiforme, astrogliosis difusa, y demielinación. Hasta la fecha, sin embargo, no se ha reportado ningún hallazgo neuropatológico en la substancia nigra ni ganglios basales. Clínicamente, Kohlhepp et al5 describió a 5 pacientes con la Enfermedad de Lyme con síntomas extrapiramidales e infección CSF documentada por B. burgdorferi. Interesantemente, el tratamiento de los pacientes con alta dosis de penicilina llevó a la normalización de su CSF y una mejoría en sus síntomas extrapiramidales.5
En primates infectados con B. burgdorferi, la autopsia de cerebro y análisis de PCR mostraron los organismos en el leptomeninges, raíces de nervios, y ganglios de la raíz dorsal, pero no en el tronco cerebral, en el cerebelo, ni en los ganglios basales.6 Los estudios histológicos e inmunohistoquímicos con policlonal, anticuerpos de anti– B. burgdorferi, confirmaron el resultado PCR en este estudio.6
En resumen, este es el primer informe publicado de SND o MSA, con características ubiquitina e inclusiones positivas de a-sinucleina, en un paciente con la infección documentada de B. burgdorferi del sistema nervioso central y clínicamente diagnosticado con parkinsonismo asociado con Lyme. Por lo tanto, este caso levanta la posibilidad de una conexión causal entre la infección de B. burgdorferi del sistema nervioso central y SND.
Damos gracias a Robert G. Beitman, MD, y Gregory P. Bach, DO, por presentarnos este fascinante caso.
REFERENCIAS
1. Duray, PH, and FW. Chandler. Lyme
disease. In: Connor DH, Chandler FW, Schwartz DA, Manz HJ, Lack EE, eds. Pathology
of Infectious Diseases. Stamford, Conn:
Appleton and Lange; 1997:635–646.
2. Kuntzer, T, J Bogousslavsky, and J
Miklossy. et al. Borrelia rhombencephalomyelopathy. Arch Neurol 1991;48:832–836. [PubMed Citation]
3. Kobayashi, K, C Mizukoshi, and T
Aoki. et al. Borrelia burgdorferi-seropositive chronic encephalomyelopathy:
Lyme neuroborreliosis?. An autopsied report. Dement Geriatr Cogn
Disord 1997;8:384–390.
4. Bertrand, E, GM Szpak, and E
Pilkowska. et al. Central nervous system infection caused by Borrelia
burgdorferi: clinico-pathological correlation of three post-mortem cases. Folia
Neuropathol 1999;37:43–51.
5. Kohlhepp, W, W Kuhn, and H.
Kruger. Extrapyramidal features in Lyme borreliosis. Eur Neurol 1989;29:150–155. [PubMed Citation]
6. Cadavid, D, T O'Neill, H Schaefer,
and AR. Pachner. Localization of Borrelia burgdorferi in the nervous system and
other organs in a nonhuman primate model of Lyme disease. Lab Invest 2000;80:1043–1054. [PubMed Citation]
7. Lowe, JS, and N. Leigh. In: Graham
DI, Lantos PL, eds. Greenfield's Neuropathology. New York, NY: Oxford University Press; 2002:343–346.
Tabla 1. Resultados de Western Blot

Tabla 2. Prueba inmunoabsorbente ligado a enzimas
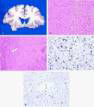
Figuras
Figura 1. Sección coronal del cerebro mostrando atrofia de ganglia basal.
Figura 2. Estriatum con pérdida neuronal y gliosis (hemotoxylin-eosin, magnificación original X 100).
Figura 3. Substancia nigra con pérdida neuronal y gliosis (hemotoxylin-eosin, magnificación original X 400).
Figura 4. Inclusiones citoplasmáticas gliales de ubiquitina-positivas (hematoxylin-eosin, magnificación original X 400).
Figura 5. Inclusiones citoplasmáticas gliales a-sinucleina positiva en el estriatum (hematoxylin-eosin, magnificación original X 200).
Presentado como un abstracto en la reunión anual del American Associatión of Neuropathologists, Denver, Colo, el 22 de junio de 2002.
Reimpresiones: Paul H. Duray, MD, Laboratory of Pathology, National Cancer Institute, National Institutes of Health, Bldg 10, Room 2N212, 10 Center Dr, Bethesda, MD 20892)